Bảng tuần hoàn các nguyên tố hóa học
Dạy học tốt xin gửi tới các bạn nội dung Bảng tuần hoàn các nguyên tố hóa học và file đính kèm để các bạn tiện tải về sử dụng. Chúc các bạn có được những thông tin như mong muốn của mình. Nào hãy cùng xem nội dung ngay bên dưới nhé.
- Các văn bản, tài liệu có thể bạn quan tâm:
- Biên bản bàn giao tài liệu mới nhất
- Biên bản chuyên đề sinh hoạt chi bộ cập nhật mới nhất
- Biên bản giao nhận hồ sơ
Trong nghiên cứu, giảng dạy và học tập hoá học thì bảng tuần hoàn (hay hệ thống tuần hoàn) các nguyên tố hoá học là một công cụ rất cần thiết. Có nhiều dạng bảng tuần hoàn khác nhau như bảng tuần hoàn dạng bậc thang, bảng tuần hoàn dạng quạt xoè, bảng tuần hoàn dạng múi nhưng phổ biến nhất là bảng tuần hoàn dạng ô (có hai loại bảng dài và bảng ngắn). Ở bài này chúng ta sẽ nghiên cứu bảng tuần hoàn dạng ô dài.
1. Tổng quan:
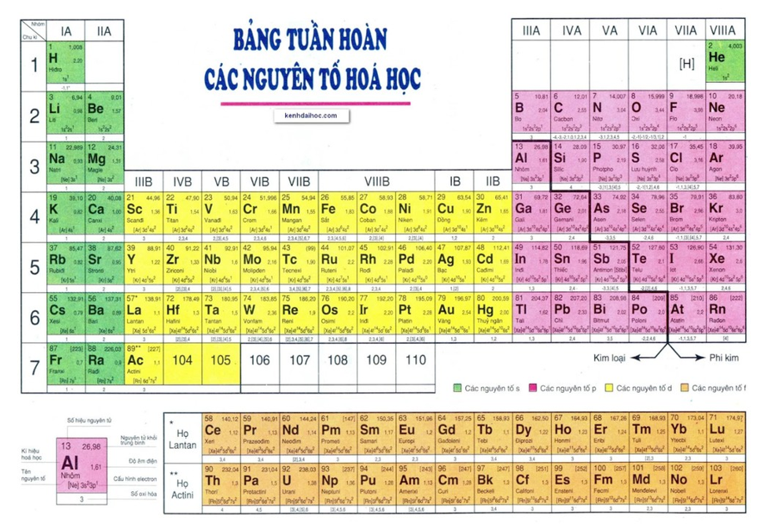
2. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố trong bảng tuần hoàn được xếp theo chiều tăng dần của điện tích hạt nhân (từ trái sang phải, từ trên xuống dưới)
- Các nguyên tố có cùng số lớp e xếp vào cùng một hàng (chu kì).
- Các nguyên tố có cấu hình e tương tự nhau được xếp vào cùng một cột (nhóm).
3. Cấu tạo bảng tuần hoàn
Ô nguyên tố
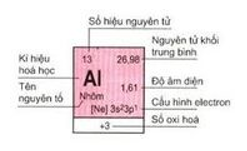
- Mỗi nguyên tố hóa học chiếm một ô trong bảng tuần hoàn được gọi là ô nguyên tố.
- Số thứ tự ô nguyên tố = số hiệu nguyên tử của nguyên tố (= số e = số p = số đơn vị điện tích hạt nhân).
Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp e, được xếp theo chiều tăng dần của điện tích hạt nhân.
- Số thứ tự chu kì = số lớp e.
- Bảng tuần hoàn hiện có 7 chu kì được đánh số từ 1 đến 7:
- Chu kì 1, 2, 3: chu kì nhỏ.
- Chu kì 4, 5, 6, 7: chu kì lớn.
- Chu kì 7 chưa hoàn thành.
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình e tương tự nhau do đó có tính chất hóa học gần giống nhau và được xếp thành 1 cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
- Nhóm A: bao gồm các nguyên tố s và p. Số thứ tự nhóm A = tổng số e lớp ngoài cùng
- Nhóm B: bao gồm các nguyên tố d và f có cấu hình e nguyên tử thì tận cùng ở dạng (n – 1)dxnsy:
- Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B.
- Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
- Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B.
Khối nguyên tố (block)
- Các nguyên tố trong bảng tuần hoàn thuộc 4 khối: khối s, khối p, khối d và khối f.
- e cuối cùng điền vào phân lớp nào (theo thứ tự mức năng lượng) thì nguyên tố thuộc khối đó.
Đặc biệt nguyên tố H hiện nay được xếp ở hai vị trí là nhóm IA và VIIA đều ở chu kì I. Nguyên tố He mặc dù có 2e lớp ngoài cùng nhưng được xếp ở nhóm VIIIA. Điều này hoàn toàn phù hợp vì H giống kim loại kiềm đều có 1e ở lớp ngoài cùng nhưng nó cũng giống các halogen vì chỉ thiếu 1e nữa là đạt cấu hình bền giống khí hiếm He; còn He mặc dù có 2e ở lớp ngoài cùng nhưng giống các khí hiếm khác là cấu hình e đó là bão hoà.
Xem và tải các văn bản tài liệu khác
- Biên bản kiểm tra hồ sơ giáo viên hàng tháng mới nhất
- Biên bản thanh lý hợp đồng thi công công trình xây dựng mới nhất
- Biên bản tổ chức sinh hoạt lớp
- Bài thu hoạch chuyên đề năm 2020 - tư tưởng Hồ Chí Minh
- Bài thu hoạch chính trị hè 2020 của giáo viên
- Bài thu hoạch về di chúc của Bác đầy đủ nhất
- Bản khai nhân khẩu mẫu HK01
- Bản kiểm điểm cá nhân mẫu 02 chuẩn nhất
- Bản đăng ký học tập và làm theo tấm gương đạo đức Hồ Chí Minh năm 2020
- Bộ sưu tập tranh tô màu siêu nhân đẹp nhất dành cho bé trai nhà bạn
- Các mẫu giấy mời họp 2020
- Cách tạo mục lục tự động trong word 2016 dễ hiểu nhất
- Cách viết bản kiểm điểm cá nhân học sinh
- Cách viết đơn xin nghỉ học dành cho học sinh, sinh viên
- Cảm âm bài hát Thần thoại
- Danh sách full các tập phim và khách mời trong Running Man
- Giấy nộp tiền vào ngân hàng nhà nước năm 2020
- Giấy đi đường cập nhật mới nhất hiện nay
- Giờ làm việc ngân hàng Vietcombank mới nhất năm 2020
- Hình nền powerpoint đẹp, chuyên nghiệp
- Xem tất cả các mẫu văn bản và tài liệu mẫu
