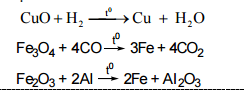Giải bài 4 trang 91 sgk hoá học 12
Bài 4. Ngâm 2,33 gam hợp kim Fe-Zn
- Bài học cùng chủ đề:
- Lý thuyết hợp kim
- Ngữ pháp tiếng anh hay nhất
Bài 4. Ngâm 2,33 gam hợp kim Fe-Zn trong lượng dư dung dịch HCl đến khi phản ứng hoàn toàn thấy giải phóng 896 ml khí H2 (đktc). Thành phần phần trăm về khối lượng của hợp kim này là
A. 27,9% Zn và 72,1% Fe B. 26,9% Zn và 73,1% Fe
C. 25,9% Zn và 74,1% Fe D. 24,9% Zn và 75,1% Fe
Lời giải:
Chọn A.
Zn + 2H+ → Zn2+ + H2
Fe + 2H+ → Fe2+ + H2
\( n_{H_{2}}=\) \( \frac{0,896}{22,4}\) = 0,04 (mol)
Gọi x và y là số mol của Zn và Fe
Ta có hệ phương trình: \( \left\{\begin{matrix} 65x+56y =2,33\\ x+y =0,04 \end{matrix}\right.\)
=> x = 0,01; y = 0,03
%mZn = \( \frac{65.0,01}{2,33}\).100% = 27,9%; %mFe = 72,1%
- Chương 1. este - lipit
- Chương 2. cacbohidrat
- Chương 3. amin, amino axit và protein
- Chương 4. polime và vật liệu polime
- Chương 5: đại cương về kim loại
- Chương 6. kim loại kiềm, kim loại kiềm thổ, nhôm
- Chương 7. sắt và một số kim loại quan trọng
- Chương 8. phân biệt một số chất vô cơ
- Chương 9. hóa học và vấn đề phát triển kinh tế, xã hội, môi trường